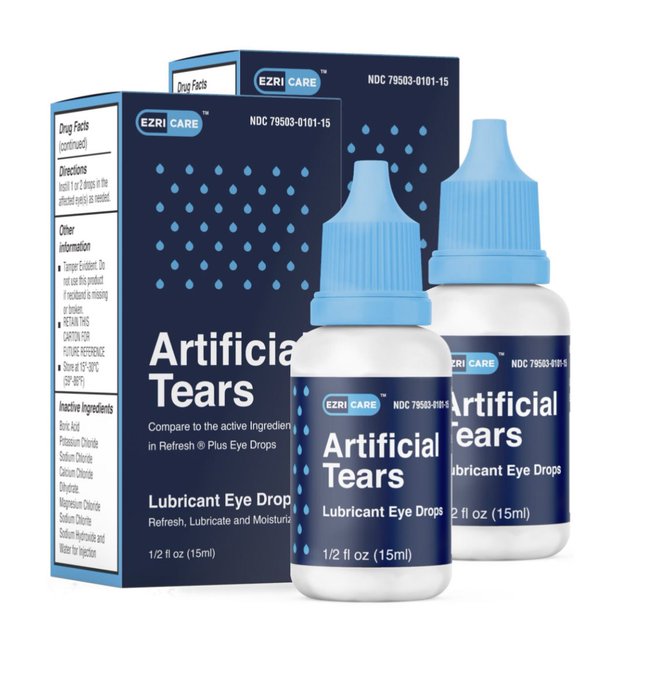
Los Centros para el Control y Prevención de Enfermedades de Estados Unidos, (CDC, por sus siglas en inglés) y la FDA están advirtiendo al personal médico y a pacientes de todo el país, evitar el uso de las gotas para los ojos distribuidos por la compañía EzriCare Artificial Tears, así lo informaron por medio de un comunicado.
El establecimiento informó el pasado 20 de enero, de una persona fallecida y de varias personas que sufrieron de infecciones y de ceguera permanente después de utilizar dicho colirio. Los CDC indicaron que estas lagrimas al no tener dentro de sus ingredientes algún tipo de conservante, permite que organismos microbiológicos puedan reproducirse fácilmente y ocasionar problemas graves de salud.
De acuerdo con Telemundo, si bien los CDC no han establecido conclusivamente que estas gotas son la causa de las infecciones que se han reportado, recomendaron a los pacientes que “suspendan de inmediato el uso de gotas de la marca EzriCare Artificial Tears hasta que se completen la investigación epidemiológica y los análisis de laboratorio”.
En la misma advertencia se unió la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés), quien también instó a los ciudadanos a no utilizar este producto por estar relacionado con el brote de una bacteria resistente a los medicamentos antibióticos, lo que provoca más riesgo de complicación en quien las use.
La agencia indicó que colabora con los CDC y los departamentos de salud estatales y locales con el objetivo de investigar el brote multiestatal que se ha presentado en el país. “Los eventos adversos asociados incluyen hospitalización, una muerte por infección del torrente sanguíneo y pérdida permanente de la visión por infecciones oculares”, sentencian desde la FDA.
En el comunicado de la FDA se lee:
La FDA advierte a los consumidores y a los profesionales de la salud que no compren y dejen de usar de inmediato las lágrimas artificiales de EzriCare o las lágrimas artificiales de Delsam Pharma debido a la posible contaminación bacteriana. El uso de lágrimas artificiales contaminadas aumenta el riesgo de infecciones oculares que podrían provocar ceguera o la muerte. Los pacientes que presenten signos o síntomas de una infección ocular deben hablar con su proveedor de atención médica o buscar atención médica de inmediato.
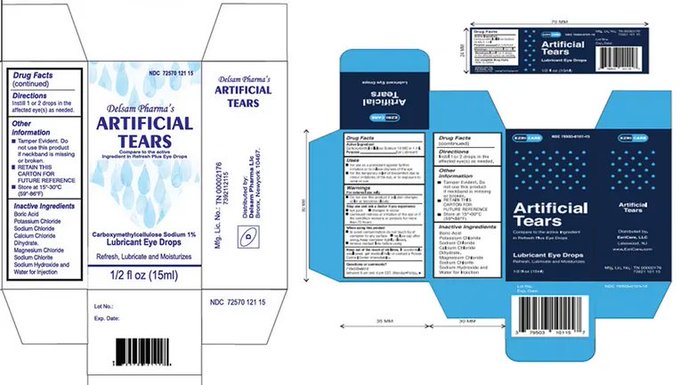
Estos son productos de venta libre, fabricados por Global Pharma Healthcare Private Limited, destinados a ser estériles.
Global Pharma inició un retiro voluntario a nivel del consumidor de todos los lotes vigentes de lágrimas artificiales de EzriCare y lágrimas artificiales de Delsam Pharma. La FDA recomendó este retiro debido a las infracciones actuales de buenas prácticas de fabricación (CGMP) de la empresa, incluida la falta de pruebas microbianas adecuadas, problemas de formulación (la empresa fabrica y distribuye medicamentos oftálmicos en botellas de usos múltiples, sin un conservante adecuado) y la falta de controles relativos a los envases a prueba de manipulaciones.
La FDA está colaborando con los Centros para el Control y la Prevención de Enfermedades (CDC) y los departamentos de salud estatales y locales para investigar un brote multiestatal que involucra una cepa de la bacteria Pseudomonas aeruginosa rara y extremadamente resistente a los medicamentos. Al 31 de enero de 2023, los CDC identificaron a 55 pacientes en 12 estados con infecciones que se vincularon por evidencia epidemiológica y de laboratorio con el uso de lágrimas artificiales EzriCare. Los eventos adversos asociados incluyen hospitalización, una muerte por infección del torrente sanguíneo y pérdida permanente de la visión por infecciones oculares. Los CDC emitieron una alerta recomendando a los consumidores que dejen de usar EzriCare Artificial Tears en espera de orientación adicional de los CDC y la FDA.
La FDA también colocó a Global Pharma Healthcare Private Limited en alerta de importación por proporcionar una respuesta inadecuada a una solicitud de registros y por no cumplir con los requisitos de CGMP. La alerta de importación impide que estos productos ingresen a Estados Unidos. La FDA alienta a los profesionales de la salud y a los pacientes a informar eventos adversos o problemas de calidad con cualquier medicamento al programa MedWatch Adverse Event Reporting de la FDA:
• Complete y envíe el informe en línea en www.fda.gov/medwatch/report.htm; o
• Descargue y complete el formulario, luego envíelo por fax al 1-800-FDA-0178.
Los consumidores también pueden reportar reacciones adversas comunicándose con los Coordinadores de Quejas del Consumidor de la FDA.
Un producto oftálmico importado desde la India
El colirio de venta libre en el país, es fabricado en la India por la empresa Global Pharma Healthcare. La FDA comunicó que a pesar de que la compañía retiró lotes no caducados de lágrimas artificiales EzriCare, y de las lágrimas artificiales de Delsam Pharma, si violó las buenas prácticas de fabricación que rigen en la actualidad. Por lo pronto la agencia ha prohibido la importación del producto a los Estados Unidos.
Infección por Pseudomonas aeruginosa
De acuerdo con MSD Manuals, los investigadores detectaron en frascos de las lágrimas de EzriCare, este tipo de bacteria considerado como un patógeno oportunista que prefiere los ambientes húmedos como la piel, los tejidos subcutáneos, el hueso, los oídos, los ojos, las vías urinarias, los pulmones , el torrente sanguíneo y las válvulas cardíacas.
De hecho para este caso, los CDC informaron que los pacientes que reportaron afecciones por el producto sufrieron de infecciones de la córnea, los líquidos intraoculares, las vías respiratorias y las vías urinarias, así como de sepsis, tras el uso de las gotas.
Pero, ¿cómo pueden las gotas oftálmicas causar infecciones en la sangre o los pulmones? Según explican los CDC, el ojo está conectado a la cavidad nasal a través de los conductos lagrimales, por lo que las bacterias pueden viajar por las vías respiratorias y llegar hasta los pulmones. Precisan que además las pseudomas pueden infectar otras partes del cuerpo a través de la circulación de la sangre o inclusive se pueden depositar sobre heridas abiertas, y por eso el riesgo de muerte por septicemia.
Los síntomas de infección por la bacteria de Pseudomonas aeruginosa, contemplan:
• Secreción ocular amarilla, verde o transparente.
• Enrojecimiento del ojo o del párpado
• Aumento de la sensibilidad a la luz y dolor o molestia ocular.
Por ahora se estudia si un antibiótico más reciente llamado cefiderocol, puede funcionar para combatir el patógeno.
Puede leer el comunicado de los CDC aquí.
¿Qué dijo la empresa EzriCare?
La compañía EzriCare dijo que ellos están cooperando con las autoridades sanitarias y que a la fecha no hay ninguna prueba que los vincule con estas reacciones adversas. En su portal de internet expresaron que el producto se fabrica en la India y que “el único papel de EzriCare, LLC en la introducción del producto en el mercado fue diseñar una etiqueta exterior y comercializarlo a nuestros clientes”.
Ante este tipo de casos expertos también recomiendan siempre averiguar sobre los productos que consumen
“Hay muchas cosas que a veces usamos para ayudarnos durante un resfriado o algo así, pero la realidad es que cada uno es diferente y antes de empezar un nuevo médico, o cualquier medicamento o suplemento debería de platicar con su médico. Y sobre todo si tienen algún padecimiento crónico”, comentó la Dra. Susana López, internista.
“Cada medicamento, cada pastilla tiene los efectos que queremos y también efectos secundarios y también otras cosas pueden interferir en los medicamentos que tenemos que tomar”, agregó la Dra. López.
Por último la compañía con sede en Nueva Jersey, esta recomendado al público en general abstenerse de utilizar el producto hasta tanto no se concluya con las investigaciones por parte de los entes de control médico y sanitario.
EzriCare, LLC recibió por primera vez el aviso de la investigación en curso de los CDC sobre un grupo multiestatal de infecciones por Pseudomonas aeruginosa el 20 de enero de 2023. A la fecha, no tenemos conocimiento de ninguna prueba que vincule definitivamente el brote de Pseudomonas aeruginosa con las lágrimas artificiales de EzriCare. No obstante, inmediatamente tomamos medidas para detener cualquier distribución o venta de lágrimas artificiales EzriCare. En la mayor medida posible, nos hemos estado comunicando con los clientes para desaconsejarles el uso continuado del producto. También nos comunicamos de inmediato con los CDC y la FDA e indicamos nuestra disposición a cooperar con cualquier solicitud que pudieran tener de nosotros.
El producto EzriCare Artificial Tears es fabricado en India por Global Pharma Healthcare PVT Limited e importado a los Estados Unidos por Aru Pharma Inc. El único papel de EzriCare, LLC en la introducción del producto en el mercado fue diseñar una etiqueta exterior y comercializarlo a nuestros clientes. EzriCare, LLC no participó en la formulación, el diseño del sistema de entrega del empaque ni en la fabricación real de este producto.
Entendemos que el mismo producto también se comercializa bajo otras marcas. Entendemos que Global Pharma Healthcare PVT Limited iniciará un retiro del producto, pero a la fecha y hora de este comunicado de prensa eso no ha sucedido. Entendemos que Global Pharma Healthcare PVT Limited está trabajando actualmente con la FDA en ese tema.
LEER MÁS: Terremoto en Turquía y Siria deja más de 1.500 muertos y heridos [IMÁGENES]