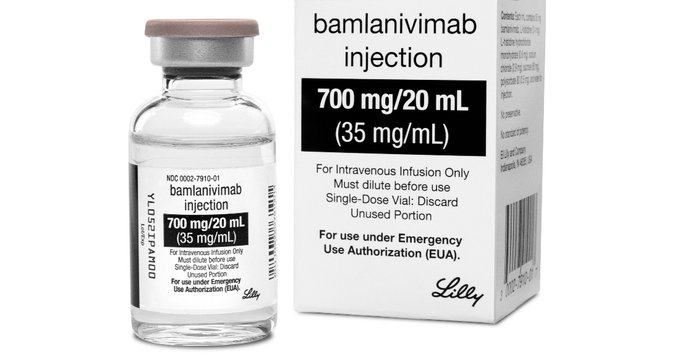
La Agencia de Alimentos y Medicamentos de Estados Unidos (FDA por sus siglas en inglés) dio la autorización de emergencia del uso del tratamiento experimental con anticuerpos monoclonales contra el Covid-19, llamado Bamlanivimab, elaborado por la farmacéutica Eli Lilly basándose en los resultados de un ensayo clínico realizado en 465 adultos no hospitalizados. Esto, luego de que se conociera que Estados Unidos había superado los 10 millones de contagios de coronavirus y suma ya más de 238.000 muertes.
Este fármaco, apunta a combatir la enfermedad solo en casos leves o moderados, para mantener a las personas infectadas con coronavirus fuera del hospital. Este medicamento, consiste en una inyección intravenosa y se realiza en una sola ocasión, va destinada a pacientes recién diagnosticados con coronavirus, y debe de aplicarse luego de obtener el resultado, dentro de los 10 días en que se desarrollan los síntomas. Además, esta también podría ofrecer protección temporal contra el contagio a la población con riesgo de infección.
Esta autorización, abarca a personas 12 años y beneficiara a los mayores de 65 años y obesas, indicó la FDA. “Si bien se sigue evaluando la seguridad y eficacia de esta terapia experimental, en ensayos clínicos se ha demostrado que Bamlanivimab reduce las hospitalizaciones o las visitas de emergencias relacionadas con COVID-19 en pacientes con alto riesgo”, ha indicado la FDA en un comunicado.
“El rápido desarrollo y disponibilidad de este fármaco, no se podría haber logrado sin el incesante trabajo de nuestro equipo, colaboración a lo largo de la industria y el trabajo urgente hecho por el gobierno para asegurar que llegue a aquellos que lo necesitan más”, dijo el CEO de Eli Lilly, David Ricks, en un comunicado.
La autorización de emergencia tendrá la misma duración que la pandemia del coronavirus, y para lograr una aprobación completa deberá de enviar más videncias, para determinar la eficacia del anticuerpo y los beneficios en los pacientes.
La farmacéutica entregará 300.000 dosis

Getty Images
El gobierno de los Estados Unidos firmó a finales del mes de octubre un acuerdo de $375 millones de dólares con la farmacéutica Eli Lilly para comprar 300.000 viales del tratamiento con anticuerpos de Bamlanivimab entregados en un plazo de dos meses, según se informó en octubre tras la firma del contrato, que hace parte del programa ‘Warp Speed’ que tiene como objetivo de conseguir en tiempo récord vacunas y terapias contra la pandemia del coronavirus. De igual manera, el país tiene la opción de comprar 650.000 viales adicionales hasta el próximo mes de junio por unos $812,5 millones de dólares.
Las acciones de Eli Lilly subieron 4,5% en las últimas operaciones del lunes
Es un fármaco similar al Regeneron con el que se trató a Donald Trump
Cuando el presidente de Estados Unidos, Donald Trump, contrajo el virus del coronavirus fue tratado con un cóctel, también de anticuerpos monoclonales, de Regeneron, que también ha solicitado autorización de urgencia. Además, durante los días que estuvo aislado, Trump aseguró que la terapia de Eli Lilly era una de las más prometedoras para hacer frente a la pandemia.
Esta aprobación se da luego de que la farmacéutica Pfizer anunciara que los resultados de sus ensayos en fase 3 de su vacuna contra el Covid-19 previene la enfermedad en el 90% de los casos.
LEER MÁS: Así reaccionaron Trump y Biden sobre la eficacia de la vacuna de Pfizer